Reaksi Adisi Elektrofilik
Reaksi adisi merupakan reaksi dimana dua buah
molekul bergabung menghasilkan molekul yang lebih besar. Tidak ada yang hilang
selama proses berlangsung. Semua atom dari molekul awal dapat ditemukan pada
molekul hasil penggabungan.
Reaksi adisi elektrofilik merupakan reaksi adisi
yang terjadi karena yang kita pikir sebagai molekul yang “penting” terserang
oleh elektrofil. Molekul yang “penting” tersebut memiliki daerah dengan
kepadatan elekton yang tinggi yang terserang oleh yang bermuatan positif.
Mekanisme Reaksi Adisi Elektrofilik
Mekanisme untuk reaksi antara eten dan
molekul X-Y
Dua atom yang berbeda yang berikatan memiliki
elektronegatifitas ang berbeda. Kita akan mengasumsikan bahwa Y lebih
elektronegatif dari X, sehingga pasangan elektron tertarik ke arah Y. Ini
berarti atom X membawa muatan yang lebih positif.
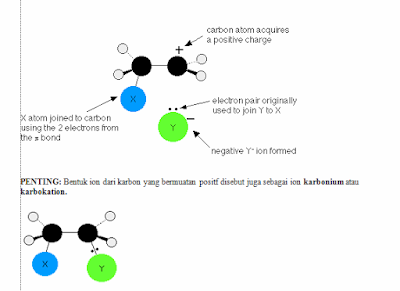
Muatan X yang lebih positif tersebut merupakan
elektrofil dan tertarik ke arah ikatan pi pada eten yang terekspos. Sekarang
bayangkan saat mereka mendekati satu sama lain.
Anda akan lebih bisa menemukan elektron pada
setengah bagian ikatan pi yang dekat dengan XY. Selama proses berlanjut, kedua
elektron pada ikatan pi bergerak lebih mendekat lagi ke arah X sampai ikatan
kovalen pun terbentuk.
Elektron
pada ikatan X-Y terdorong seluruhnya kearah Y dan memberikan ion negatif Y- .
Pada tahap terakhir dari reaksi elektron pada
pasangan bebas ion Y- tertarik dengan kuat ke arah atom karbon. Terbentuklah
ikatan koordinasi antara Y dan atom karbon.
Gerakan dari berbagai macam pasangan elektron
ditunjukkan dengan menggunakan panah melengkung.
PERMASALAHAN :
1. Apa yang dimaksud dengan ikatan phi?
2. Mengapa ikatan phi sering terputus dan elektronnya dipakai untuk berikatan dengan atom lain?
3. Mengapa ikatan phi biasanya lebih lemah dari ikatan sigma?
4. Mengapa struktur karbon lebih stabil pada ikatan tunggal daripada pada ikatan rangkap?
Referensi :
https://www.academia.edu/5469002/Adisi_Elektrofilik
https://www.slideshare.net/LindaNaafi/ikatan-pi-dan-ikatan-sigma
https://www.slideshare.net/LindaNaafi/ikatan-pi-dan-ikatan-sigma






Baiklah saya akan mencoba menjawab permasalahan anda yang ke 3 yaitu mengapa ikatan phi lebih lemah dri pada ikatan sigma . Karena : , rapatan elektronnya lebih jauh dari inti atom yang bermuatan positif, sehingga memerlukan lebih banyak energi. Dari sudut pandang mekanika kuantum, kelemahan ikatan ini dijelaskan oleh ketumpangtindihan yang sangat sedikit di antara orbital p oleh karena orientasinya yang paralel.
BalasHapusWalaupun ikatan pi lebih lemah dari ikatan sigma, ikatan pi seringkali merupakan komponen dari ikatan rangkap bersamaan dengan ikatan sigma. Kombinasi dari ikatan sigma dan pi lebih kuat dari ikatan pi dan sigma yang berdiri sendiri. Kekuatan ikatan yang bertambah dari ikatan rangkap diindikasikan oleh banyak pengamatan, namun yang paling menonjol adalah kontraksi panjang ikatan.
Saya akan mencoba menjawab permasalahan yang Anda tampilkan pada No.2
BalasHapusJawabannya yaitu :
Elektron pada ikatan phi bebas untuk bergerak dimanapun pada daerah tersebut.
Elektron ikatan phi tidak sepenuhnya berada dibawah pengaruh inti atom karbon, tidak seperti pada ikatan sigma dan karena terletak pada bagian atas dan bawah dari molekul, lebih rentan terhadap serangan.
Saya akan mencoba menjawab pertanyaan no 1 .ikatan pi (ikatan π) adalah ikatan kimia kovalen yang dua cuping orbital atom yang berlektron tunggal bertumpang tindih dengan dua cuping orbital atom lainnya yang juga berlektron tunggal. Hanya terdapat satu bidang simpul dari orbital yang melewati dua inti atom.ikatan ini lebih lemah dibandingkan dengan ikatan sigma
BalasHapusSaya rini (a1c116008)akan menjawab permasalahan no 4
BalasHapusJawab: karena karbon memiliki ciri khusus dapat mengikat 4 tangan senyawa lain sehingga stabil serta dapat lebih mudah ikatan masuk dan struktur tepat.