Pengertian Senyawa Organologam
Senyawa organologam
adalah senyawa di mana atom-atom karbon dari gugus organik terikat kepada atom
logam. Contoh, suatu aloksida seperti (C3H7O)4Ti
tidaklah dianggap sebagai suatu senyawa organologam karena gugus organiknya
terikat pada Ti melalui oksigen, sedangkan C6H5Ti(OC3H7)3 karena
terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam
Ti.HH Istilah organologam biasanya didefenisikan agak longgar, dan senyawaan
dari unsur-unsur seperti Boron, fosfor, dan silikon semuanya mirip
logam. Tetapi untuk senyawa yang mengandung ikatan antara atom logam
dengan oksigen, belerang, nitrogen, ataupun dengan suatu halogen tidak termasuk
sebagai senyawa organologam. Dari bentuk ikatan pada senyawa organologam,
senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan
anorganik.
Sifat senyawa organologam yang umum ialah atom
karbon yang lebih elektronegatif daripada kebanyakan logamnya. Senyawa komplek
logam (biasanya logam-logam transisi) merupakan senyawa yang memiliki satu atau
lebih ikatan logam-karbon. Senyawa organologam terdiri dari atom pusat dan
ligan (Blaser et al, 2000).
Terdapat
beberapa kecenderungan jenis-jenis ikatan yang terbentuk pada senyawaan
organologam:
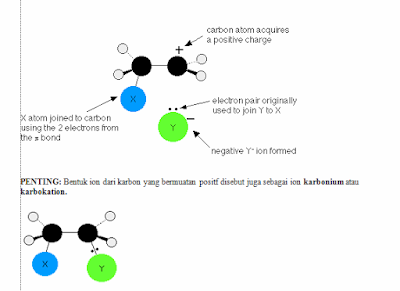
a. Senyawaan ionik dari
logam elektropositif
Senyawaan organo dari logam yang relatif
sangat elektropositif umumnya bersifat ionik, tidak larut dalam pelarut
organik, dan sangat reaktif terhadap udara dan air. Senyawa ini terbentuk bila
suatu radikal pada logam terikat pada logam dengan keelektropositifan yang
sangat tinggi, misalnya logam alkali atau alkali tanah. Kestabilan dan
kereaktifan senyawaan ionik ditentukan dalam satu bagian oleh kestabilan ion
karbon. Garam logam ion-ion karbon yang kestabilannya diperkuat oleh
delokalisasi elektron lebih stabil walaupun masih relatif reaktif. Adapun
contoh gugus organik dalam garam-garaman tersebut seperti (C6H5)3C-Na+ dan
(C5H5)2Ca2+.
b. Senyawaan
yang memiliki ikatan -σ (sigma)
Senyawaan organologam dimana sisa
organiknya terikat pada suatu atom logam dengan suatu ikatan yang digolongkan
sebagai ikatan kovalen (walaupun masih ada karakter-karakter ionik dari
senyawaan ini) yang dibentuk oleh kebanyakan logam dengan keelektropositifan
yang relatif lebih rendah dari golongan pertama di atas, dan sehubungan dengan
beberapa faktor berikut:
1. Kemungkinan penggunaan
orbital d yang lebih tinggi, seperti pada SiR4 yang tidak
tampak dalam CR4.
2. Kemampuan donor alkil atau
aril dengan pasangan elektron menyendiri.
3. Keasaman Lewis sehubungan
dengan kulit valensi yang tidak penuh seperti ada BR2atau koordinasi
tak jenuh seperti ZnR2.
4. Pengaruh perbedaan
keelektronegatifan antara ikatan logam-karbon (M-C) atau karbon-karbon (C-C).
c. Senyawaan
yang terikat secara nonklasik
Dalam banyak senyawaan organologam terdapat
suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk
ionik atau pasangan elektron/kovalensi. Misalnya, salah satu kelas alkil
terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam
hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom
Boron pada B(CH3)3. Atom B termasuk atom golongan IIIA,
dimana memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk
konfigurasi oktet dalam senyawaannya.
Konsep Dasar Organologam Dan Reaksi-Reaksi
Pembentukan Organologam
Pada dasarnya
Organologam prinsipnya yaitu atom-atom Karbon dari gugus organik terikat kepada
atom logam. Konsep ini yang mendasari Organologam, sehingga banyak cara untuk
menghasilkan ikatan-ikatan logam pada Carbon yang berguna bagi kedua logam
transisi dan non-transisi. Beberapa yang lebih penting adalah sebagai berikut:
1. Reaksi Logam langsung ;
sintesis yang paling awal oleh ahli kimia Inggris, Frankland dalam
tahun 1845 adalah interaksi antara Zn dan suatu alkil Halida. Adapun yang lebih
berguna adalah penemuan ahli kimia Perancis, Grignard yang dikenal sebagai
pereaksi Grignard. Contohnya interaksi Magnesium dan alkil atau aril Halida
dalam eter:
Mg + CH3I → CH3MgI
Interaksi langsung
alkil atau aril Halida juga terjadi dengan Li, Na, K, Ca, Zn dan Cd.
2. Penggunaan zat
pengalkilasi. Senyawa ini dimanfaatkan untuk membuat senyawa organologam
lainnya. Kebanyakan Halida nonlogam dan logam atau turunan Halida dapat
dialkilasi dalam eter atau pelarut hidrokarbon, misalnya :
PCl3 + 3C6H5MgCl →
P(C6H5)3 + 3MgCl2
VOCl3 + 3(CH3)3SiCH2MgCl
→ VO(CH2SiMe3)3 + 3MgCl2
3. Interaksi Hidrida Logam atau nonlogam
dengan alkena atau alkuna.
4. Reaksi Oksidatif adisi. Reaksi yang
dikenal sebagai reaksi Oksa dimana Alkil atau Aril Halida ditambahkan pada
senyawa logam transisi Koordinasi tidak jenuh menghasilkan ikatan logam Karbon.
Contohnya:
RhCl(PPh3)3 + CH3I →
RhClI(CH3)(PPh3)2 + PPh3
5. Reaksi Insersi yaitu reaksi yang
menghasilkan ikatan-ikatan dengan Karbon, sebagai contoh:
SbCl5 + 2HC CH→Cl3Sb(CH=CHCl)2
CH→Cl3Sb(CH=CHCl)2
Atom pusat dari suatu senyawa kompleks yang
digunakan antara lain logam-logam transisi deret pertama seperti: Cr, Mn, Fe,
Co, Ni, Cu, dan Zn (HIjazi et al, 2008). Ligan dari suatu senyawa
komplek dapat mempengaruhi bentuk geometri dari senyawa organologam itu sendiri
sehingga dapat dimanfaatkan dalam berbagai reaksi kimia. Tabel 1 menjelaskan
tentang perbedaan jenis ligan yang terikat pada atom pusat, dimana memberikan
bentuk geometri yang berbeda dan perbedaan reaksi yang mampu dikatalisisnya.
Tabel 2.1 Senyawa komplek organologam dengan perbedaan ligan, geometri, dan
reaksi yang dapat dikatalisisnya (Blaser et al, 2000).
Metal oxidation
state
|
Example
|
Geometry
|
Preferred reaction
|
Ni0
|
Ni(CO4)
|
Tetrahedral
|
Ligan dissociation
|
Pd0
|
Pd(PR3)2
|
Linear
|
Oxidative addition
|
NiII Pd II
|
ArPd(PR3)2X
|
Square planar
|
Reductive
elimination
|
RhI Ir I
|
Rh(PR3)3X2
|
Square planar
|
Oxidative addition
|
Ru II
|
Ru(PR3)3X2
|
Trigonal pyramid l
|
Ligan dissociation
Oxidative addition
|
Ru II Rh III
|
Rh(Pr3)3XH2
|
Octahedral
|
Reductive
elimination
|
Ir III
|
Pada kompleks logam ada tiga jenis keadaan tereksitasi yaitu:
a. Logam-centered
(MC), eksitasi elektron dari T2g ke orbital Eg,
b. Ligan-centered
(LC) yang menyatakan transisi dari p-p*,
c. Transfer
elektron dari logam ke ligan (MLCT).
Singlet-singlet serapan merupakan transisi elektronik dari orbital logam T2g
ke orbital ligan kosong atau berpusat pada ligan yaitu dari orbital p untuk
orbital p* kosong. Sebaliknya, singlet-triplet serapan yang transisinya dengan
spin berubah dan dilarang, karena terkait dengan koefisien kepunahan kecil (Baranoff
et al.,2009).
Terdapat dua macam ikatan organologam, yaitu :
·
Ikatan ionik. Ikatan ionik organologam terbentuk dari unsur yang sangat
elektropositif
yaitu unsur pada golongan I, II, dan III. Organologam dengan
yang berikatan secara ionik bersifat tak larut dalam pelarut hidrokarbon dan
mudah teroksidasi.
·
Ikatan kovalen. Ikatan kovalen organologam yang
mudah menguap terbentuk dari logam Zn, Cd, Hg, dan logam non-transisi gologan
III (kecuali aluminium), IV, dan V. Ikatan kovalen ini terbentuk dengan cara
memberikan satu elektron tunggalnya, baik dari logam maupun unsur organiknya,
untuk dipakai secara bersama. Sifat dari senyawa organologam dengan ikatan
kovalen ini mudah menguap, larut dalam pelarut organik, dan tidak larut dalam
air.
PERMASALAHAN :
1 Apa fungsi utama dari senyawa organologam ?
2 Sebutkan senyawa organologam pada pengolahan hasil minyak bumi!
3 Apa yang menyebabkan suatu senyawa organologam memiliki ikatan
sigma?
Referensi :